Kolorowy układ okresowy... - blok d
Czasem mówi się o jakieś brudnej rzece, że można tam spotkać całą tablice Mendelejewa. W rzeczywistości cały układ okresowy nie byłby potrzebny - wszak nie wszystkie pierwiastki mają możliwość tworzenia barwnych związków, które mogłyby zmienić kolor wody. Dlaczego?
Do zrozumienia tego tematu potrzebna jest podstawowa wiedza o mechanice kwantowej.
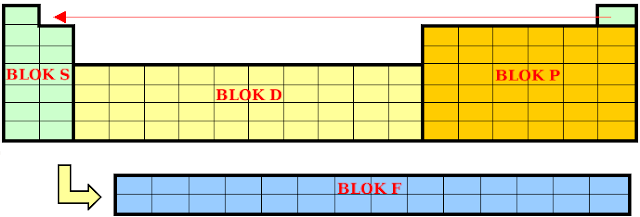
Ze względu na podpowłokę na jakiej znajdują się elektrony walencyjne, układ okresowy dzielimy na 4 bloki energetyczne:
 |
| chemiatolubie |
 |
| Barwne roztwory związków pierwiastków bloku d. Od lewej: Co(NO3)2(czerwony); K2Cr2O7 (pomarańczowy); K2CrO4 (żółty); NiCl2 (turkusowy); CuSO4(niebieski); KMnO4 (fioletowy). |
Przy całkowicie zapełnionej podpowłoce d lub braku na niej elektronów, związki tych pierwiastków są bezbarwne (nie ma wolnych miejsc/elektronów, więc nie następują przejścia elektronów, które pobierałyby kwanty energii).
 |
| zapełnianie podpowłoki d |
Na barwę ma również wpływ hydratacja, ale o tym opowiem w następnym wpisie 😊

Komentarze
Prześlij komentarz