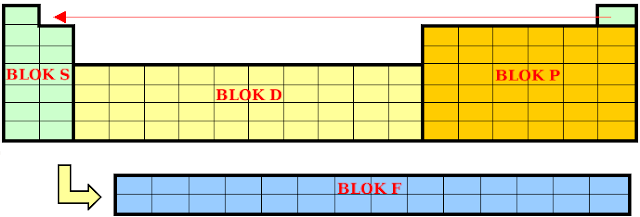
Zapewne wielokrotnie w swoim życiu widziałeś pokazy fajerwerków. Barwne ognie rozświetlały nocne niebo. Zastanawiałeś się kiedyś, skąd bierze się ich kolor? i.pinimg.com Wszystkie te piękne kolory stworzone są przez spalające się różne sole metali. Słowem, ich mechanizm działania jest identyczny jak w doświadczeniu, które zapewne widział każdy zainteresowany chemią: barwienie płomienia palnika przez sole metali. kwantowo.pl Ale skąd biorą się te kolory? W podgrzanych pierwiastkach, pod wpływem zastrzyku energii elektrony wskakują na wyższą powłokę, a wracając do stanu podstawowego wyrzucają foton o określonej energii. Każdy pierwiastek zachowuje się w sposób charakterystyczny, a emitowane przez niego światło stanowi swoisty kod kreskowy. Jeśli długości wysyłanych fal znajdują się w tak zwanym zakresie widzialnym widma elektromagnetycznego to wydaje się jakby pierwiastek "barwił" płomień palnika. Niektó...